胶质母细胞瘤(GBM)是最常见和最致命的成人原发性脑肿瘤,5年生存率仅为10%左右。目前的标准疗法只能对GBM患者提供适度缓解,而且最终会复发。肿瘤微环境(TME)的最新研究进展揭示了其在GBM异质性和驱动治疗耐药性中的重要作用。
GBM的肿瘤微环境中存在多种髓系细胞群,包括肿瘤相关巨噬细胞(TAM)、树突状细胞(DC)、髓源性抑制细胞(MDSC)和中性粒细胞。值得注意的是,TAM是GBM 肿瘤微环境中最显著的基质细胞群,占整个肿瘤体积中细胞总数的50%。
陈佩文团队之前的研究已经证明,GBM细胞中PTEN的缺陷可上调赖氨酸氧化酶,诱导巨噬细胞向肿瘤微环境的浸润。这些浸润的巨噬细胞支持GBM细胞的生存,产生功能性肿瘤-巨噬细胞共生。此外,GBM的肿瘤相关巨噬细胞(TAM)通常极化为免疫抑制表型,以抑制T细胞活性,从而促进肿瘤进展、免疫抑制和治疗耐药。这些发现扩展了我们对细胞-细胞共生相互作用如何促进GBM进展的理解。
虽然已经提出了许多针对这种共生相互作用的治疗策略,但GBM中免疫细胞的单细胞分析表明,其肿瘤相关巨噬细胞(TAM)是一种异质性和可塑性的细胞群,可以很容易地适应环境变化和治疗干预。因此,继续研究针对这种共生相互作用,是改善GBM患者预后的可行策略。
近日,美国西北大学陈佩文团队在 Cell 子刊 Cell Reports Medicine 上发表了题为:Hypoxia-driven protease legumain promotes immunosuppression in glioblastoma 的研究论文。
该研究发现,LGMN是肿瘤相关巨噬细胞(TAM)中高度表达的关键蛋白酶,并且在胶质母细胞瘤(GBM)标志性的缺氧肿瘤微环境下被缺氧诱导因子1-α(HIF1α)转录上调。在GBM小鼠模型中,LGMN的增加是TAM免疫抑制极化所必需的,并且抑制HIF1α-LGMN轴会损害肿瘤生长,减少免疫抑制TAM,增强CD8+T细胞的浸润和活化,提高抗PD-1治疗的抗肿瘤效果。
总的来说,该研究发现并揭示了HIF1α-LGMN轴在调节胶质母细胞瘤的免疫抑制中发挥的关键作用及机制,表明其可作为提高GBM免疫治疗有效性的新靶点。

蛋白酶与各种癌症类型的肿瘤进展有关。最初,它们被认为是促进肿瘤侵袭的蛋白水解酶,因为它们具有降解细胞外基质(ECM)的肿瘤相关蛋白水解活性。然而,越来越多的证据表明,蛋白酶在迁移、粘附、凋亡、增殖、衰老、自噬和血管生成等多个过程中发挥着更重要的作用。不幸的是,使用广谱蛋白酶抑制剂的临床试验未能改善癌症患者的预后,并且还发现了多种具有抗肿瘤作用的蛋白酶。
在GBM中,几种精氨酸特异性蛋白酶,例如MALT1、MMP2和MMP9,它们的表达高于低级别胶质瘤和正常大脑组织。遗传学或药理学抑制这些蛋白酶,可抑制GBM小鼠模型中的肿瘤生长。同样,敲低SerpinB3或ADAMDEC1会破坏胶质瘤干细胞的维持并抑制GBM的生长。这些发现支持了蛋白酶在调节GBM中的关键作用。
然而,它们之间的相互关系和与GBM免疫抑制性肿瘤微环境的相关性尚不清楚。在这项研究中,研究团队筛选了可能调节GBM中免疫抑制性肿瘤微环境的蛋白酶。在这个筛选中,Legumain(LGMN)成为可能有助于肿瘤相关巨噬细胞(TAM)免疫抑制的首选。
LGMN是一种属于半胱氨酸蛋白酶C13家族的天冬酰胺肽酶,在天冬酰胺残基的C端切割肽键,并参与各种细胞过程,如破骨细胞形成、抗原加工、肾脏功能和大脑发育。由于LGMN可以切割淀粉样蛋白前体蛋白(APP)和tau蛋白,因此被认为是阿尔茨海默病的潜在治疗靶点。
LGMN广泛分布于乳腺癌、结肠癌、肺癌、胃癌、淋巴瘤、黑色素瘤、脑癌等不同类型的癌症中,其在肿瘤中的表达与预后较差相关。
在这项研究中,研究团队确定了肿瘤相关巨噬细胞(TAM)是LGMN的关键来源,揭示了LGMN在连接缺氧和免疫抑制两个GBM的标志中的作用,并揭示了LGMN是提高GBM抗PD-11治疗效率的潜靶点。
具体来说,LGMN作为肿瘤相关巨噬细胞(TAM)中高度富集的关键蛋白酶出现,并被缺氧诱导因子1-α(HIF1α)转录上调。在功能上,增加的LGMN通过激活GSK-3β-STAT3信号通路促进TAM免疫抑制极化。在GBM小鼠模型中,抑制巨噬细胞HIF1α和LGMN,可减少TAM免疫抑制极化,损害肿瘤进展,增强CD8+T细胞介导的抗肿瘤免疫,并与抗PD-1治疗产生协同作用。
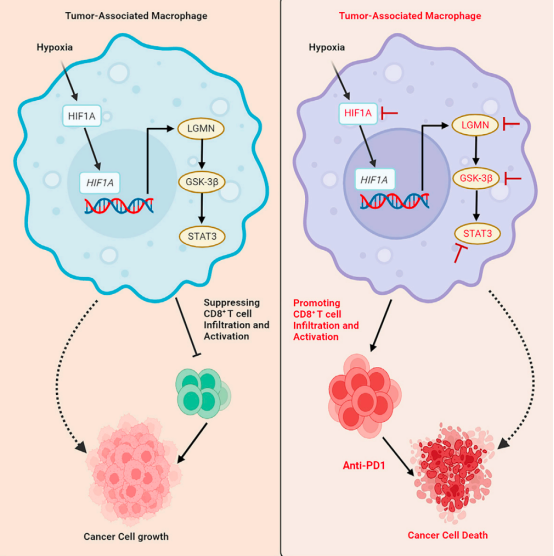
因此,LGMN是连接缺氧和免疫抑制这两个GBM标志的关键分子开关,为这种致命疾病提供了可行的治疗干预新靶点。